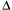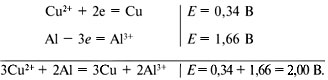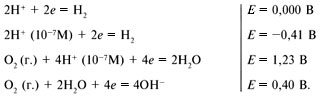УО.С.ЗАЙЦЕВ
УЧЕБНАЯ КНИГА ПО ХИМИИ
http://him.1september.ru/articlef.php?ID=200404209
ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10 КЛАССОВ,
РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИКЗАДАЧНИКЛАБОРАТОРНЫЙ ПРАКТИКУМНАУЧНЫЕ РАССКАЗЫ ДЛЯ ЧТЕНИЯ
Продолжение. См. № 4–14, 16–28, 30–34, 37–44, 47, 48/2002;
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23,
24, 25-26, 27-28, 29, 30, 31, 32, 35, 36, 37, 39, 41, 42, 43, 44 , 46 , 47/2003;
1, 2, 3, 4, 5, 7, 11, 13, 14, 16, 17, 20, 22, 24, 29, 30, 31, 34, 35, 39, 41/2004
§ 8.2. Реакции на границе металл–раствор
(продолжение)
Составим цепь из двух электродов, например, медного и цинкового. Обсудим три варианта такого гальванического элемента.
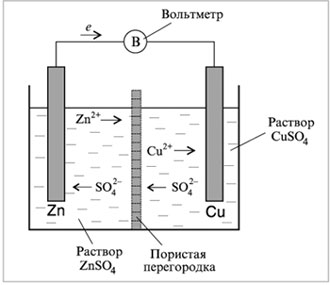
Сразу скажем, что первый вариант нам будет неинтересен. Опустим цинковую и медную пластинки в стакан с раствором их солей – сульфатов цинка и меди (рис. 8.6). Соединим электроды проводниками через прибор для измерения напряжения – вольтметр, который на рисунке обозначен символом «В».
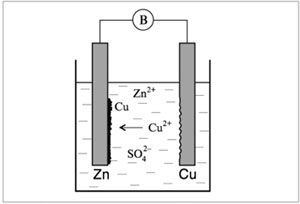 |
Рис. 8.6. |
И цинк, и медь посылают в раствор свои ионы, но равновесие соответствующих реакций смещено в сторону металлов, т. к. они находятся не в чистой воде, а в растворе, содержащем ионы этих металлов. Несмотря на это, цинк обладает более высокой способностью посылать в раствор ионы и иметь более высокое отрицательное значение электродного потенциала. Поэтому ионы меди устремятся к цинковому электроду, и на цинке образуется медь:
Zn + Cu2+ = Zn2+ + Cu.
Переход электронов происходит непосредственно на поверхности цинка, разность потенциалов между пластинками не возникает, и вольтметр не покажет напряжения.
Изменим опыт. Поместим в сосуд перегородку из пористой керамики (рис. 8.7).
|
Рис. 8.7. |
Электроны покидают цинк и по проводнику через вольтметр переходят на медь, где взаимодействуют с ионами меди, в результате чего медь осаждается на медном электроде. Одновременно ионы цинка переходят в раствор.
Пористая перегородка служит для того, чтобы не допустить подхода ионов меди к цинку и тем самым предотвратить прямой переход электронов с цинка на ионы меди вместо перехода по проводнику. По мере прохождения реакции ионы цинка переходят от цинка к меди, аналогичное происходит с ионами меди.
Пористая перегородка плохо предотвращает смешение растворов, и, кроме того, изготовление сосудов с пористой перегородкой затруднительно, поэтому можно поступить следующим образом. Возьмем два стакана, нальем в них растворы, которые соединим электролитическим мостиком – П-образной стеклянной трубкой, заполненной насыщенным раствором хлорида калия (рис. 8.8).
В концы трубок вставлены ватные тампоны, чтобы жидкость из мостика не выливалась.
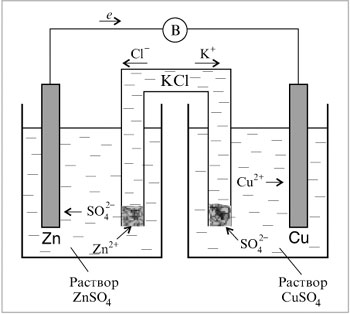 |
Рис. 8.8. |
Итак, пористая перегородка заменена электролитическим мостиком. В нем хлорид-ионы двигаются к цинковому электроду, а ионы калия – к медному электроду. Мостик разделяет электродные пространства, предотвращает электропроводность за счет перемещения ионов цинка и меди, понижает потенциал, возникающий при контакте двух различных растворов. Дополнительный потенциал также возникает при движении ионов с различными скоростями, а ионы калия и хлорид-ионы передвигаются с почти одинаковыми скоростями.
Составим цепь (см. рис. 8.8) из стандартных медного и цинкового электродов (концентрации ионов металлов в растворах по 1 моль/л). Определим направление реакции в этом гальваническом элементе и его ЭДС:
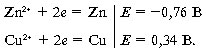
Потенциал цинкового электрода имеет отрицательный знак, а медного – положительный. Следовательно, цинковый электрод обладает большей способностью отдавать электроны, и на нем будет проходить противоположно направленная реакция, а медный электрод будет электроны принимать:
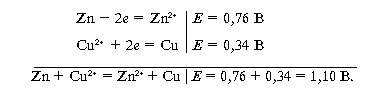
Таким образом, если мы погрузим кусок металлического цинка в раствор сульфата меди, то цинк будет переходить в раствор в виде ионов и одновременно на нем будет осаждаться слой меди.
В списке электродных потенциалов есть реакция:
2H+ (10–7M, вода) + 2e = H2 (г.), Е = –0,41 В.
Это потенциал водородного электрода в воде. Все металлы, которые расположены в списке выше и электродные потенциалы которых имеют более высокие отрицательные значения, должны реагировать с водой («растворяться») с образованием водорода. Но вы прекрасно знаете, что железо, хром, цинк, алюминий при обычных условиях с водой не реагируют. Магний реагирует с горячей водой, а натрий, кальций, калий и литий реагируют с водой при обычных условиях. Это объясняется тем, что на железе, хроме, цинке, алюминии образуются малорастворимые оксидные пленки, исключающие доступ воды к металлу. При удалении слоя оксида начинается взаимодействие этих металлов с водой. Оксиды или гидроксиды натрия, кальция, калия, лития растворимы в воде и не защищают металлы от контакта с водой.
Для электродных реакций, потенциалов и ЭДС применимы все те формулы, которые мы раньше вывели для окислительно-восстановительных реакций:
![]() G = –nЕF =
G = –nЕF = ![]() G = –nЕF =
G = –nЕF =  Н – Т
Н – Т![]() S = –RT ln K = –nЕ•96 484 = –2,303•8,314•Т lg К.
S = –RT ln K = –nЕ•96 484 = –2,303•8,314•Т lg К.
При вычислении константы равновесия помните, что кристаллические фазы (металлы) в выражение константы равновесия не записываются, т.к. концентрация кристаллического вещества не зависит от его количества, т.е. постоянна. Например:
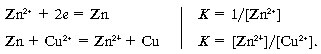
Электродные потенциалы и ЭДС электрохимических реакций очень сильно зависят от концентраций ионов и рН среды. Поэтому часто предсказываемое для стандартных условий направление процесса не совпадает с тем, которое осуществляется при данных условиях.
О том, как определить направление реакции при нестандартных условиях, смотрите в учебниках химии для высшей школы.
§ 8.2. Реакции на границе металл–раствор
(продолжение)
Электрохимическая коррозия
Все металлы и изделия из них (за исключением золота и платины) подвергаются разрушению в результате химического взаимодействия с окружающими их веществами. В самом общем случае эти процессы называются коррозионными, или просто коррозией. Суммарный химический процесс коррозии в системе «вещество–окружение» всегда самопроизволен, т.е.
G < 0, хотя отдельные реакции могут иметь
G < 0, хотя отдельные реакции могут иметь
G > 0, проходя под воздействием других реакций.
Ниже пойдет речь об электролитной, или электрохимической, коррозии металлов. Эта коррозия обусловлена образованием гальванических элементов при контакте различных металлов. Корродирующие и заставляющие корродировать вещества создают сложнейшую систему взаимосвязанных реакций, имеющих различные значения изобарных потенциалов, констант скорости и энергий активации. Эта система настолько сложна, что часто для новых металлических материалов или сред коррозия оказывается непредсказуемой.
Почему гвоздь во влажной древесине доски ржавеет и через некоторое время полностью превращается в бурую непрочную массу (рис. 8.9)?
Рис. 8.9.
Схема образования ржавчины на железном гвоздеВ кристаллической решетке железа находятся ионы и электроны:
Fe (кр.) – 2е = Fe2+ (кр.).
Для электрохимической коррозии железа необходимы вода и кислород воздуха. Начало коррозии заложено в известном вам процессе самопроизвольного перехода ионов Fe2+ в раствор:
Fe (кр.) – 2e = Fe2+ (р-р).
Ионы Fe2+ диффундируют по влажной древесине и одновременно переходят в ионы Fe3+:
Fe2+ – е = Fe3+.
Этот переход совершается благодаря тому, что кислород воздуха, реагируя с водой, использует образовавшиеся электроны:
О2 + 2Н2О + 4е = 4ОН–.
Далее ионы Fe3+ образуют с ионами ОН– тригидроксид железа:
Fe3+ + 3ОН– = Fe(ОН)3.
Это самая примитивная схема ржавления железа. Одновременно протекают многочисленные параллельные и последовательные реакции. Ионы Fe2+ и Fe3+ гидролизуются с образованием осно’вных ионов и гидроксидов Fe(ОН)2 и Fe(ОН)3. Гидроксид Fe(ОН)3 может быть представлен также формулой 2Fe(ОН)3 или Fe2О3•3Н2О. Это одна из формул вещества ржавчины. В действительности состав тригидроксида железа или гидратированного триоксида железа неопределенен: Fe2О3•nН2О.
К этим реакциям добавляются реакции гидроксидов и осно’вных ионов с углекислым газом, в результате чего образуются осно’вные соли железа типа Fe(ОН)СО3 или (Fе(ОН)2)2СО3.
Приведенные выше реакции взаимосвязаны, и все смещают равновесие перехода ионов железа в раствор.
Суммарно и приближенно процесс ржавления железа может быть выражен следующим уравнением:4Fe +2H2O + 3O2 = 2(Fe2О3•Н2О).
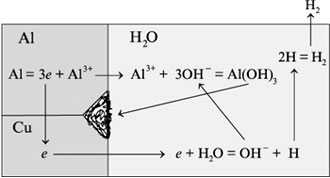
Если со столба электричество подается к дому алюминиевым проводом, который у наружной стены скручивается с медным проводом, то место соединения двух проводов скоро перестает проводить электричество из-за образования в месте контакта гидроксида или оксида алюминия. Точно так же алюминиевая заклепка, соединяющая два листа меди, быстро разрушается, если место контакта не было покрыто краской. Причина этого неприятного явления вам станет понятной, если вы сравните электродные потенциалы меди и алюминия:
Алюминий обладает большей способностью отдавать электроны по сравнению с медью, поэтому в водном растворе проходят реакции:
Следовательно, при контакте меди с алюминием алюминий будет в виде ионов переходить в раствор и далее осаждаться в месте контакта в виде гидроксида Al(OH)3.
На рис. 8.10 показано, что происходит в месте контакта алюминия и меди.
Рис. 8.10.
Схема процесса коррозии
при контакте алюминия и медиИоны алюминия из кристаллической решетки алюминия переходят в раствор, а электроны поступают на медь и на ее поверхности реагируют с водой с образованием гидроксид-ионов, которые с ионами алюминия образуют гидроксид алюминия. Коррозия алюминия продолжается, т.к. электроны непрерывно уходят из него, смещая тем самым равновесие в сторону образования ионов. Это самое простое описание коррозии при контакте двух металлов.
Аналогичные процессы происходят, если металл не чистый и содержит вкрапления других металлов.
Изучение коррозии всегда преследует цель ее предотвращения или замедления. Простейшая защита железа от коррозии заключается в его изоляции от влаги и воздуха, для чего железо покрывают краской, полимерной пленкой или жироподобными веществами. Однако самыми эффективными способами защиты являются способы, основанные на термодинамических и кинетических принципах. Некоторые важнейшие способы защиты от коррозии состоят в следующем.
Электрохимическая коррозия предотвращается контактом разрушающегося от нее металла с металлом, имеющим более отрицательный электродный потенциал. Например, железо в контакте с цинком или покрытое им (оцинкованное железо) не подвергается коррозии в связи с тем, что в образующемся гальваническом элементе растворяется цинк, а на железе выделяется водород.Из справочных данных:
следует, что цинк по сравнению с железом обладает большей способностью к передаче ионов в раствор:
Цинк будет реагировать с ионами железа, если они образуются при коррозии, и будет выделяться металлическое железо. Другими словами, цинк смещает равновесие между железом и его ионами в сторону металлического железа.
Цинк в контакте с железом растворяется в водной среде, а образовавшийся отрицательный заряд в виде электронов переходит на железо.
Возникающая повышенная концентрация электронов в железе препятствует его переходу в виде ионов в раствор, т.е. защищает его от коррозии. В результате благодаря реакции с водой на железе выделяется водород:2Н2О + 2е = Н2 + 2ОН–.
Цинк, защищая железо от коррозии, переходит в гидроксид цинка:
Zn2+ + 2ОН– = Zn(ОН)2.
Поэтому железо с цинком имеет белый налет – слой или даже скопления гидроксида цинка (или оксида цинка).
Электрохимическая коррозия главным образом вызывается примесями и различного вида неоднородностями, выходящими на поверхность металла. При соприкосновении металла с электролитом, которым может быть просто влага, адсорбируемая или конденсирующаяся на поверхности, возникают гальванические элементы.Благодаря этим гальваническим элементам металл растворяется, а на загрязнениях и примесях в кислотной среде выделяется водород, а в нейтральной и щелочной – кислород:
Почему в скобках второго и третьего уравнений указана концентрация ионов водорода – 10–7М, а в первом уравнении концентрация не указана (чему она равна?)?
Заметим, что в обычных условиях при коррозии водород в свободном виде не выделяется, т.к. окисляется атмосферным кислородом и превращается в воду уже в момент образования.
Интересна одна особенность коррозии – в течение весьма длительного начального периода скорость коррозии довольна низкая и значительно возрастает со временем. Это связано с постепенным накоплением на поверхности тех включений, которые в начале коррозии находились не на поверхности металла и не образовывали микрогальванических элементов.
Другой способ защиты состоит в том, что легко корродирующий металл в виде куска размещается поблизости от защищаемого металла и соединяется с ним проводником. Это может быть цинк или магний. Для магния:Mg2+ + 2e = Mg, E = –2,37 B.
Напишите уравнение реакции между магнием и ионами железа, рассчитайте ЭДС реакции и объясните, почему использование магния предпочтительнее использования цинка.
§ 8.2. Реакции на границе металл–раствор
(продолжение)
Электролиз
Это слово вам хорошо знакомо. Вы можете перечислить, где используется электролиз? Сейчас вы узнаете, что происходит при пропускании постоянного электрического тока через расплав и водный раствор хлорида натрия. Вы также узнаете, что автомобильный аккумулятор при разрядке (его использовании) работает как гальванический элемент, а при его зарядке в нем проходит электролиз. Вам также будет полезно прочитать некоторые советы по эксплуатации аккумулятора.
При прохождении электрического тока через металлы (проводники 1-го рода) химические реакции не идут, и металлы остаются неизменными. Если же электрический ток проходит через раствор или расплав электролита (проводники 2-го рода), на границе электролит – металлический проводник (электрод) происходят различные химические реакции и образуются новые вещества. Этот процесс называется электролизом.
При электролизе положительно заряженные ионы (катионы) перемещаются к отрицательно заряженному электроду, катоду, а отрицательно заряженные ионы (анионы) – к положительному электроду, аноду. При этом, однако, не всегда катионы и анионы электролита разряжаются, принимая или отдавая электроны. Часто в реакциях электролиза принимает участие растворитель-электролит, например вода.
Принципиальное различие между реакциями в гальваническом элементе и электролизере заключается в их направленности и самопроизвольности. В замкнутой цепи гальванического элемента электрохимическая реакция протекает самопроизвольно, а в электролизере – только под действием электрического тока внешнего источника.
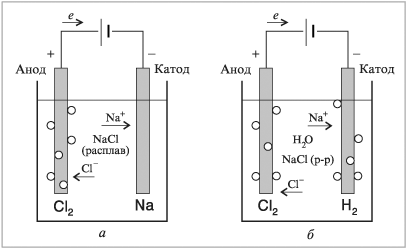
Рассмотрим электролиз расплавленного хлорида натрия и его водного раствора. На рис. 8.12 показаны схемы обоих вариантов электролиза. Вам следует увидеть и объяснить их различия. Опустим в расплавленный (выше 800 °С) хлорид натрия два графитовых электрода, которые соединим с положительным и отрицательным полюсами источника электрического тока (батарея, аккумулятор, выпрямитель переменного тока).
|
Рис. 8.12. |
В расплавленном состоянии хлорид натрия представляет собой отрицательно заряженные хлорид-ионы и положительно заряженные ионы натрия. Хлорид-ионы, анионы, в электрическом поле передвигаются в сторону положительного электрода – анода, на котором они отдают электроны и превращаются в атомный хлор и далее в молекульный хлор, который и выделяется из электролизера:
2Cl– – 2e = Cl2.
В электрическом поле ионы натрия, катионы, передвигаются к отрицательному электроду – катоду, на котором происходит разряжение ионов и образование жидкого металлического натрия:
Na+ + e = Na.
Поскольку плотность жидкого натрия меньше плотности расплавленного хлорида натрия, он всплывает в прикатодном пространстве. Чтобы не произошло электрического соединения катода с анодом (замыкание), следует в электролизере предусмотреть перегородку между катодом и анодом.
При электролизе катионы и анионы передвигаются навстречу друг другу.
Теперь посмотрите на схему электролиза растворенного в воде хлорида натрия и, прежде чем читать далее, перечислите как можно больше отличий.
Электролиз раствора хлорида натрия существенно отличается от электролиза расплава хлорида натрия, хотя в водном растворе также хлорид натрия находится в виде ионов натрия и хлорид-ионов.
Ионы натрия, катионы, в растворе хлорида натрия направляются к отрицательно заряженному электроду – катоду. В старых или низкого уровня учебниках химии можно прочитать, что на катоде образуется натрий, который сразу же реагирует с водой, и образуется водород. Но в действительности дело обстоит совсем не так.
Сравним электродные потенциалы воды и натрия:
![]()
Эти данные показывают, что для приема электронов водой с образованием водорода и гидроксид-ионов требуется значительно меньшее напряжение по сравнению с напряжением в случае приема электронов ионами натрия.
Теперь подумайте, какие вещества будут образовываться на катоде или концентрироваться в прикатодном пространстве.
К катоду будут устремляться катионы натрия, но они разряжаться не будут, а из воды будут образовываться водород и гидроксид-ионы. Ионы натрия и гидроксид-ионы сделают раствор вблизи катода щелочным.
Хлорид-ионы у анода разряжаются, и выделяется свободный хлор:
2Cl– – 2е = Cl2, E = –1,36 В.
То, что вы прочитали, – это самое простое описание электролиза водного раствора хлорида натрия.
Продукты электролиза раствора хлорида натрия зависят от его концентрации. Электролиз разбавленного раствора хлорида натрия проходит без разряжения хлорид-ионов, а разлагается вода с выделением кислорода и накоплением ионов водорода (соляная кислота):
2Н2О – 4е = О2 + 4Н+, Е = –1,23 В.
По мере повышения концентрации соли на аноде вместе с кислородом начинает выделяться хлор:
2Cl– – 2e = Cl2.
А в концентрированных растворах образуется хлор с примесью кислорода, т.е. в этом случае основными продуктами электролиза являются водород, хлор и гидроксид натрия.
При электролизе раствора хлорида натрия на основной процесс образования хлора накладываются реакции хлора с водой и последующие превращения образующихся веществ. Гидролиз хлора проходит с образованием слабой хлорноватистой кислоты HClO и хлорид-ионов (сильная соляная кислота):
Сl2 + H2O = H+ + Cl– + HClO.
При повышении температуры образуются хлорат-ионы ClO3–:
3Cl2 + 3H2O = ClO3– + 5Cl– + 6H+,
3HClO = ClO3– + 2Cl– + 3H+,
3ClO– = ClO3– + 2Cl–.
Если электролиз разбавленного раствора хлорида натрия проводится в химическом стакане или другом подобном сосуде, то растворы ионов водорода (кислота) и гидроксид-ионов (щелочь) смешиваются, и электролиз сводится к образованию водорода и кислорода. Если же анодное и катодное пространства разделить перегородкой (мембраной), пропускающей ионы-переносчики электрического тока, но препятствующей смешению приэлектродных растворов, то можно в качестве продуктов электролиза получить растворы кислоты и щелочи.
Напряжением разложения электролита при электролизе называется минимальное напряжение, которое нужно приложить к электродам для получения продуктов электролиза. Напряжение разложения не может быть меньше ЭДС соответствующего гальванического элемента. Например, рассмотрим электролиз раствора хлорида натрия. Электродные потенциалы равны:
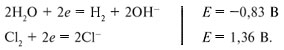
В гальваническом элементе протекают процессы:
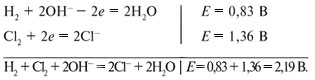
ЭДС реакции водорода с хлором в щелочной среде равна 2,19 В, и самопроизвольно может проходить именно эта реакция. Но в электролизере не самопроизвольно, а под воздействием прилагаемого напряжения проходит противоположная реакция:
2Cl– + 2Н2О = Н2 + Сl2 + 2ОН–.
Чтобы реакция проходила, необходимо напряжение не менее 2,19 В, т.е. напряжение разложения при электролизе водного раствора хлорида натрия равно 2,19 В. Напряжение разложения составляется из потенциалов разряжения ионов.
Однако реальное напряжение, которое следует приложить к электродам, всегда оказывается больше расчетного из-за того, что на электродах по различным причинам возникает повышенное сопротивление прохождению электрического тока, которое необходимо преодолеть, прилагая более высокое напряжение. Разность между реальным напряжением разложения и теоретически найденным из электродных потенциалов ЭДС соответствующей реакции называют перенапряжением.
Перенапряжение зависит от материала электрода, его формы, состояния поверхности, плотности тока, температуры раствора, интенсивности перемешивания раствора и других факторов. При образовании газообразных продуктов в большинстве случаев перенапряжение бывает весьма значительным. При образовании кислорода перенапряжение особенно велико, а при выделении галогенов незначительно.
Роль перенапряжения двойственна. С одной стороны, перенапряжение приводит к повышенному расходу электроэнергии при электролизе, но, с другой стороны, благодаря перенапряжению удается осаждать из водных растворов многие металлы, которые по значениям их стандартных электродных потенциалов осаждаться не должны: Fe, Pb, Sn, Ni, Co, Zn, Cr. Благодаря перенапряжению, а также влиянию концентрации раствора на электродный потенциал возможны электролитическое хромирование и никелирование железных изделий, а на ртутном электроде удается даже получить из водного раствора натрий.
Потенциал разряжения катиона иногда называют потенциалом осаждения металла. Это тот минимальный потенциал, который должен быть приложен к электроду для того, чтобы катион потерял заряд и произошло осаждение металла. Для некоторых ионов (Fe3+, Cu2+, Ag+, Cd2+) потенциал осаждения близок к электродному потенциалу, для других же ионов (Fe2+, Co2+, Ni2+) потенциалы осаждения значительно превышают электродные потенциалы металлов, и для их осаждения электролизом необходимо приложить определенное перенапряжение.
При электролизе водных растворов электролитов часто вместо металла на катоде выделяется водород. Такие катионы, как Na+ или К+, в водном растворе вообще не разряжаются, а выделяется водород.
В кислотных средах водород образуется по реакции:
2Н+ + 2е = Н2,
а в нейтральных и щелочных средах – по реакции:
2Н2О + 2е = Н2 + 2ОН–.
Катионы могут быть сгруппированы по продуктам электролиза:
| Катионы | Продукты электролиза |
|---|---|
| Li+, K+, Na+, Mg2+, Al3+ | H2 |
| Mn2+, Zn2+, Cr3+, Fe2+ (pH = 7, нейтральная среда) | Mеталл + H2 |
| Co2+, Ni2+, Sr2+, Pb2+ (pH = 0, кислотная среда) | Металл + H2 |
| Cu2+, Ag+, Pt2+, Au3+ | Металл |
Обратите внимание, что для некоторых катионов возможно одновременное образование металла и водорода. В ряду катионов от Li+ до Al3+ металл при электролизе водных растворов не образуется, а выделяется водород (требуется значительное перенапряжение) за счет восстановления воды. В ряду катионов от Mn2+ до Pb2+ при электролизе образуются одновременно металл и водород, и в совсем немногочисленной группе катионов от Cu2+ и до Au3+ образуется только металл.
Следовательно, чем меньше отрицательное значение электродного потенциала и выше его положительное значение, тем легче выделить металл электролизом из водного раствора его соли.
Если к раствору, содержащему несколько катионов, приложить постепенно возрастающее напряжение, то электролиз начинается тогда, когда достигается потенциал осаждения металла с самым высоким (наиболее положительным) электродным потенциалом. Например, при электролизе раствора, содержащего ионы цинка (Е = –0,76 В) и меди (Е = 0,34 В), сначала выделяется медь и лишь после того, как почти все ионы меди разрядятся, начнет выделяться цинк. Таким образом, если в растворе одновременно содержатся различные катионы, то при электролизе можно выделить соответствующие металлы последовательно согласно значениям их электродных потенциалов.
Что касается разряжения анионов при электролизе водных растворов, следует помнить, что галогенид-ионы (и другие не содержащие кислорода ионы) разряжаются. Кислородсодержащие анионы обычно не разряжаются, и вместо них в электролизе участвуют молекулы воды или гидроксид-ионы в щелочных растворах:
2Н2О – 4е = О2 + 4Н+,
4ОН– – 4е = О2 + 2Н2О.
Если раствор содержит хлорид-ионы (Е = 1,36 В), бромид-ионы (Е = 1,09 В) и йодид-ионы (Е = 0,54 В), то сначала будут разряжаться анионы с самым низким (наменьшим) потенциалом и далее с более высоким (йод, бром и хлор). Фторид-ионы в водном растворе вообще разряжаться не могут (Е = 2,87 В).
Обсудим несколько примеров.
• При электролизе раствора серной кислоты (графитовые электроды) происходят следующие процессы:
на катоде: 2Н+ + 2е = Н2,
на аноде: 2Н2О – 4е = О2 + 4Н+.
Суммарное уравнение:
2Н2О = 2Н2 + О2.
Таким образом, при электролизе раствора серной кислоты за счет разложения воды выделяются водород и кислород.
• Электролиз раствора сульфата меди:
на катоде: Сu2+ + 2e = Cu,
на аноде: 2Н2О – 4е = О2 + 4Н+.
Суммарное уравнение:
2Сu2+ + 2Н2О = 2Cu + О2 + 4Н+.
В результате электролиза сульфата меди образуются медь, кислород и серная кислота.
С законами электролиза вы знакомы из курса физики. Напомним некоторые наиболее важные положения.
Если через раствор, содержащий ионы серебра Ag+, пропустить постоянный ток силой 1 А в течение 1 с, на катоде выделится 0,001118 г металлического серебра (точнее, 0,001117975 г). Количество электричества, выделяющее это количество серебра, называется кулоном, т.е. 1 Кл = 1А•1с.
Чтобы из раствора выделить 1 моль серебра, следует пропустить через раствор однозарядных ионов Ag+ число Авогадро электронов, или 1 моль их. Чтобы из раствора выделить 107,8682 г серебра (1 моль), через раствор следует пропустить
107,8682/0,001117975 = 96 485 Кл
электричества. Это число называют постоянной Фарадея F, или числом Фарадея, а иногда просто Фарадеем. Постоянная Фарадея F – одна из фундаментальных физико-химических констант. Число Фарадея равно произведению заряда электрона e на число Авогадро NA:
1F = 1,6022•10–19•6,022•1023 = 96 485 Кл/моль.
Поскольку 96 485 Кл электричества выделяют при электролизе массу металла, равную его атомной массе, если ионы металла однозарядны, то серебра выделится 107,8682 г. Если же через раствор сульфата меди пропустить 96 485 Кл электричества, то выделится не 63,546 г меди, а в два раза меньшее количество – 31,773 г, т.к. ионы меди двухзарядны. Если пропустить 1F электричества через раствор трехзарядных катионов, то будет получено количество металла, в три раза меньшее его атомной массы.
Если вам придется заниматься электролизом, запомните два выражения:
F = 96 485 Кл/моль и 1 Кл = 1А•1с.
Они помогут вам вычислить количество электричества, необходимое для осаждения заданного количества металла, и время пропускания тока известной силы:
1F = 96 485 Кл/моль = 96 485 А•с/моль = 26,8 А•ч/моль.
Масса выделившегося металла m (г), сила тока I (А), время t (с), атомная масса металла А (г/моль) и заряд его ионов n связаны соотношением:
m = AIt/(nF) = AIt/(96 485n).